筆記目錄
接續上一篇,終於進入重點啦!
FDA 在接下來的文章中將一一介紹 AI/ML-Based SaMD 的產品全生命週期(TPLC)四大區塊監管方式的初步構想。
PART I:Quality Systems and Good Machine Learning Practices (GMLP)
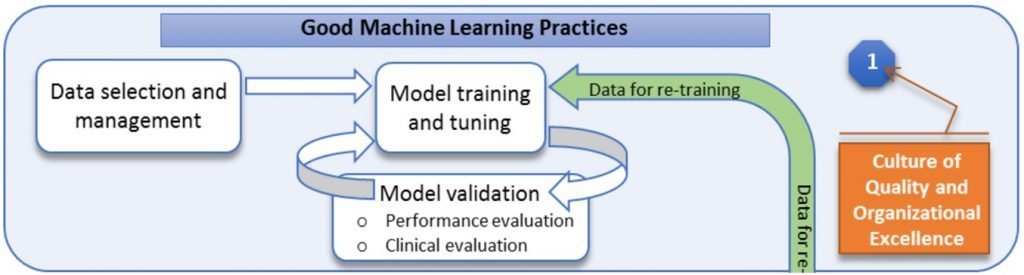
就像是一般醫療器材廠需要建立品質系統來確保產品從初期研發到上市販賣到退出市場的品質,(AI/ML-Based) SaMD 的廠商未來可能也需要建立 GMLP 以展現 CQOE (Robust culture of Quality and Organizational Excellence),且需要依照〈SaMD: Clinical Evaluation guidance〉進行以下三階段的臨床評估 (Clinical Evaluation):
- 有效的臨床關聯性 (Valid Clinical Association)
- 又稱為科學有效性。
- 透過文獻搜尋、臨床研究、醫療學會的臨床指引、臨床試驗來證明 (AI/ML-Based) SaMD 輸出資訊的相關臨床理論依據可精準地對應產品宣稱的適用情況,也就是要想辦法說明「(AI/ML-Based) SaMD 輸出的資訊對於預期臨床用途有多少臨床意義和信心」。
- 分析驗證 (Analytical Validation)
- 目的是要證明 (AI/ML-Based) SaMD 可以正確、穩定地處理輸入資訊產出精確的輸出資訊。
- 我覺得這就像是一般醫療器材在設計開發流程中後期進行的 Verification,以保證「設計輸出 = 設計輸入」。
- 臨床確效 (Analytical Validation)
- 目的是要確認 (AI/ML-Based) SaMD 是否可產出有臨床意義的資料,以符合預期用途。
- 我覺得這就像是一般醫療器材在設計開發流程後期進行的 Validation,以保證「設計輸出 = 預期用途」。
建議大家去看 CDE 針對這主題的中文介紹 –〈醫療器材軟體之臨床評估〉。
PART II:Initial Premarket Assurance of Safety and Effectiveness &
PART III:Approach for modifications after initial review with an established SPS and ACP
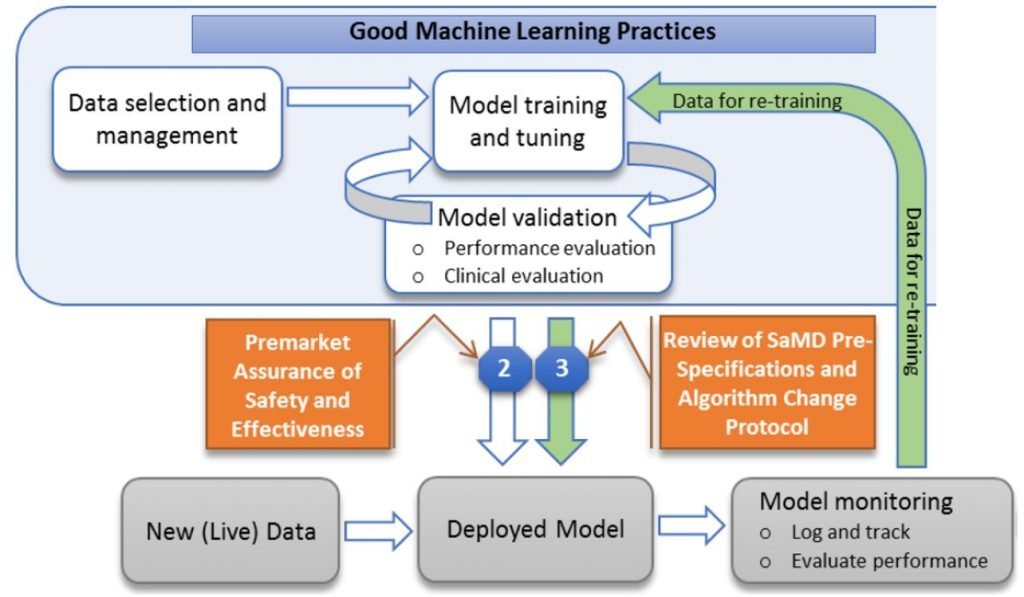
這兩區塊是在說明「上市前審查」與「上市後修改規格」的途徑。
和以往的上市前審查需繳交的資料不同,AI/ML-based SaMD 的首次上市前審查 (Initial premarket review) 的審核資料中需包含上市後的修改計畫,稱為「Predetermined change control plan」。FDA 在上市前審查除了確認 AI/ML-based SaMD 的安全與功效外,還會考量對使用者/病患的利弊來審核 Predetermined change control plan 是否足以控管上市後修改所產生的風險。
Predetermined change control plan 包含 SaMD Pre-Specifications (SPS) 和 Algorithm Change Protocol (ACP) 兩部分。
SPS,是在描述 AI/ML-based SaMD 預計在未來實際應用於臨床時可能會變更部分 (Region of potential changes),例如,修改表現 (Performance)、輸入資料 (Inputs) 或預期用途 (Intended use);
ACP,是在描述如何適當地控管 SPS 中那些變更發生時所產生的風險。
簡單來說,SPS 是描述 AI/ML-based SaMD 的「什麼 (What)」可能會在上市後經由得到更多的資訊而學習並變更;ACP 是描述 AI/ML-based SaMD「如何 (How)」在維持相同 (或更好) 安全與功效的原則下學習並變更。
下方表格是 FDA 對於 ACP 內容的初步構想:

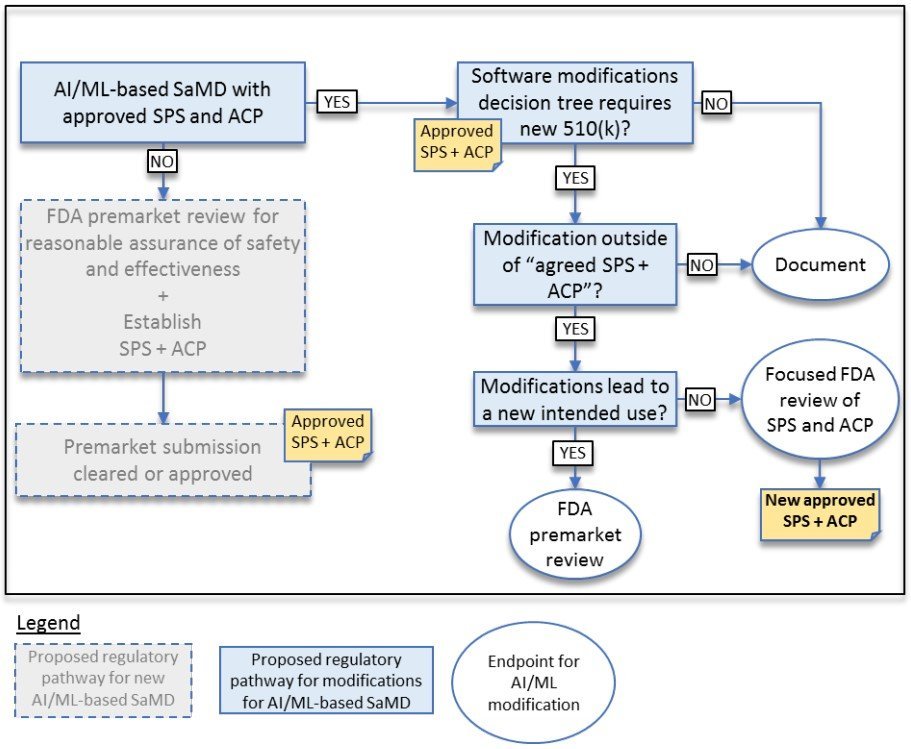
FDA 在這段中提到,SPS 和 ACP 還是有限制的。例如,可能不適合說「未來可透過 AI/ML 學習與修改軟體,使得原本利用影像管理傷口癒合的軟體而修改為可以診斷黑色素瘤」,因為這樣的修改是大幅變更軟體風險,將「Healthcare situation or condition」由「Non-serious」變更為「Critical」。
上面在說明上市前審查時,廠商需有 SPS 說明未來軟體上市後,會因為 AI/ML 的學習和優化能力可能有哪些變更,並透過 ACP 來保障軟體在學習與優化之後可以至少維持一樣的安全與功效。
下圖則是在說明軟體上市後變更是只要執行公司內部設計變更管制並留存紀錄,或需要和 FDA 一起重新重點檢視 (Focused review) SPS 和 ACP,抑或是需再次申請上市前審核的判斷途徑。
PART IV:Transparency and real-world performance monitoring of AI/ML-based SaMD
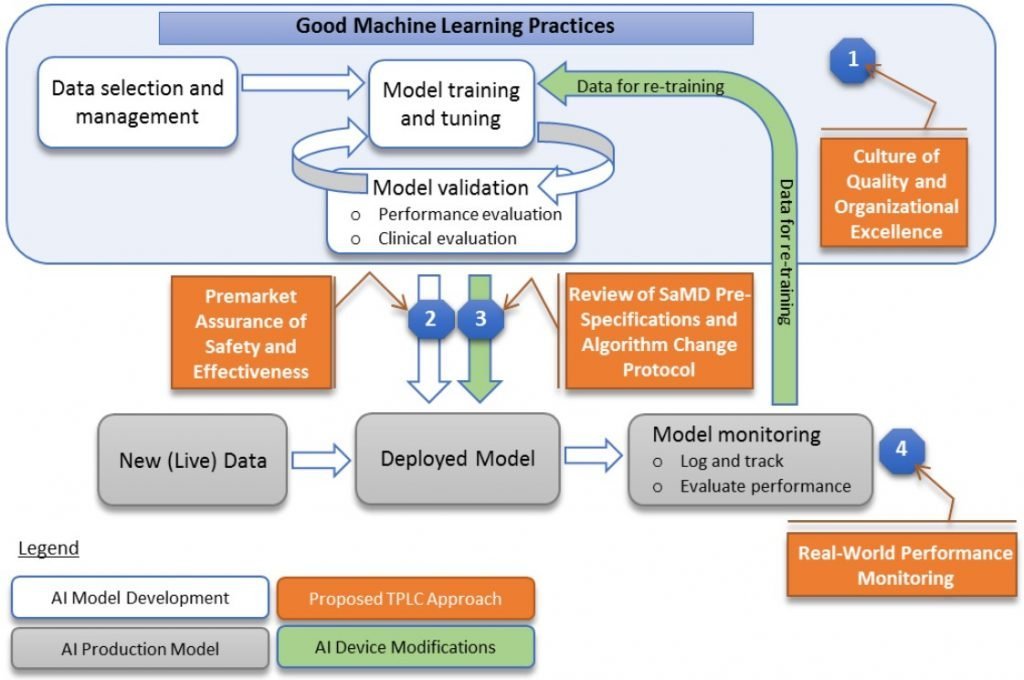
TPLC approach 目的是保障醫療器材在設計開發、上市前審核、量產並合法銷售用於臨床用途,一直到產品退出市場不再販售的所有面向都可以有一定的安全與功效。
在此部分,FDA 強調「透明度 (Transparency)」和「監控真實世界使用的表現 (Real-world performance monitoring)」對於確保像 AI/ML-based SaMD 這類會一直隨使用情況而改變的醫療器材的安全與功效尤為重要。
透明度 (Transparency),代表了在變更時需確保有正確且完整地修改標示 (Labeling) 去描述軟體變更的內容。例如,輸入資料的變更、軟體表現的變化或與相關設備、配件相容性的改變,且廠商也需要建立一個機制決定:
- 「如何 (How)」通知大家軟體更新內容。例如,透由 Email、Software notification;
- 「什麼 (What)」資訊要通知大家。例如,要提供怎樣的資訊可以讓大家明瞭新版本與舊版本軟體的差異。
另外,關於監控真實世界使用的表現 (Real-world performance monitoring) 則可能透過定期報告、Digital Health Software Precertification (Pre-Cert) Program 中的分析真實世界表現結果,或一個我還搞不清楚是啥的 Case for Quality 來達到目的。至於報告的形式與頻率,則會依產品的風險等級、修改的次數與內容、演算法的成熟度來決定。另外,如果有參加像是 Case for Quality 或 Pre-Cert Program 這類的試行計畫,則有另外的途徑來持續確保產品的安全與功效。
FDA 在這篇文章中提出了可以讓 AI/ML-based SaMD 在上市後利用自己工作中學到的經驗優化表現(擬人寫法!),但又可以確保安全與功效。
總之,完整的概念由四大區塊組成,如下圖所示:
呼,我真不會整理重點,又不小心囉嗦打了那麼多字。
FDA 在最後面的兩篇附錄提供了 AI/ML-based SaMD 的上市後學習並優化的範例,以及 Algorithm Change Protocol(ACP)暫定的內容。
這兩個附錄,等…我有力氣再來做個筆記吧 ORZ…
– 2017/07/21 @ 星巴克文化門市 STARBUCKS
