筆記目錄
延續本站上篇〈eCopy Program for Medical Device Submissions〉的內容,接著在此詳述怎樣符合 eCopy Program for Medical Device Submissions 規定。
FDA 在〈eCopy Program for Medical Device Submissions〉指引內規定,廠商須符合此指引附件一列出的技術標準 (Section A ~ Section D),若不符合,則 FDA 不會接受送審文件,相關檔案會進入 eCopy hold 狀態直到符合技術標準的 eCopy 提供給 FDA。
下面六步驟,幫助大家完成合格的 eCopy。
Step 1 – 建立 Cover Letter
關於 Cover Letter,須符合以下要求:(詳細 cover letter 內容可參考 FDA 網站 Content of a 510(k))
- 要有簽名 (數位簽名或傳統墨水簽名都可)。
- 要有聯絡方式,包含電話號碼及電子郵件地址。
- 要描述送審形式,例如,510(k)、PMA、或 Pre-Submission。
- 要描述是哪種審核階段,例如,original、amendment、supplement、或 report。
- 如已有送審追蹤編號 (submission tracking number),則須寫上。
- 除了一份紙本的 Cover letter 外,FDA 還建議 (但非必須) 放一份 PDF 檔在 eCopy 中。
- FDA 建議不要將送審階段的缺失回覆寫進 cover letter 中,而是放進送審文件主體中作為一個章節。
Step 2 – 決定文件架構
選擇 volume-based 或 non-volume-based 的文件架構。
Non-Volume-Based eCopy
- 建議用於送審文件量不大時。
- 此方法就是一個一個 PDF 檔,沒有其他資料夾。
- 在指引 P.19 有放幾個不同送審形式的檔案編碼方式。例如下列的架構:
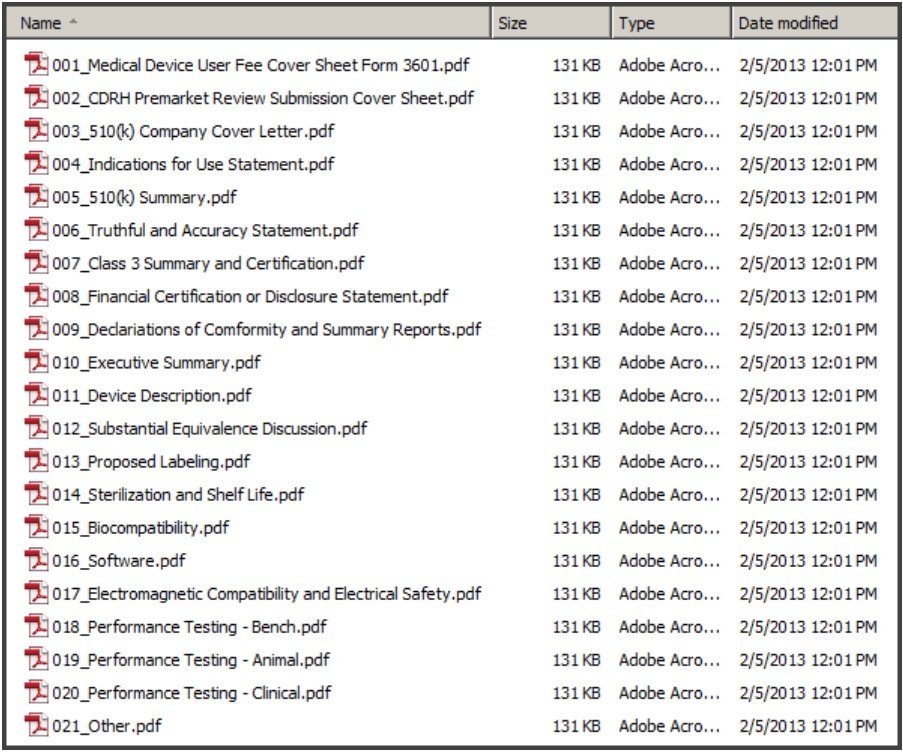


Volume-Based eCopy
- 當送審文件較多或複雜時,建議使用此法。
- 相較於 Non-Volume-Based,此法會將不同的 PDF 放進各個不同的資料夾 (volumes) 中。範例如下:


- 資料夾 (volume) 中「只」可以放進 PDF,不可放其他檔案格式。
- 資料夾 (volume) 內不可再放資料夾 (subfolders)。
- 資料夾的命名方式為:1) VOL_xxx_Descriptive Name (e.g., VOL_001_Mechanical Testing),或 2) VOL_xxx (e.g., VOL_001)。
- 如要加上 Descriptive Name,則最多只能 125 字元、可有空格、破折號 (dash)、底線 (underscore)、句號 (period);但不可有非英文字母或以下的特殊符號:

- 資料夾名稱不可重複,且須為連號 (例如,第一個資料夾名稱為 VOL_001,第二個資料夾須為 VOL_002)。
- Volume-Based eCopy 容許在第一階時,同時存在資料夾 (volume) 和至少一個 PDF。例如,Fig. 5 範例就是將 cover letter PDF 單獨放在一階,其他都是資料夾 (volume)。
Step 3 – PDF 要求
無論選擇 volume-based 或 non-volume-based 的文件架構,PDF 都是主要檔案格式。以下為 PDF 的要求:
- 檔案名稱命名原則需為:xxx_Descriptive Name
- 若為 volume-based 的文件架構,資料夾 (volume) 內的 PDF 也須遵守上列的命名原則。
- 名稱所用的字元要求和資料夾 (volume) 的規定是相同的 (最多只能 125 字元、可有空格…;不可有非英文字母或某些特殊符號)。
- PDF 開頭前三碼僅用來讓 FDA 的軟體可以依序儲存,依不同單位的審查規定,審查員可能不會看到 PDF 的開頭三碼數字。因此,
- 就算是 volume-based 文件架構的 VOL_002,裡面的 PDF 也是從 001_、002_ 開始編碼。
- PDF 的 Descriptive Name 要讓審查員可以看出文件內容。
- 用 Adobe Acrobat PDF version 11 (或更舊版) 將原始檔案轉成 PDF (不可掃描後再轉 PDF,畫質會下降)。
- 沒有附加檔案
- 當廠商在 PDF 中放入附加檔案時,現行版 eSubmitter software 不會顯示出錯誤訊息。(是 “eSubmitter software” 還是 “eCopies Validation Module”?)
- 但廠商不可故意在 PDF 中放入附加檔案,因為當 FDA 將 eCopy 放進他們系統中時,這些 PDF 中的附加檔案會被移除,審查員將無法看到這些附加檔案。
- FDA 鼓勵廠商使用 hyperlinks 或 bookmarks
- 常用「藍字」來標示 hyperlinks。
- 若使用 hyperlinks 或 bookmarks 來連結不同的 PDF,則要確定 hyperlinks 或 bookmarks 是有效的。(例如,使用相對路徑而非絕對路徑;建立超連結後不可修改檔名…等。)
- 由原始文件 (例如,Microsoft Word document) 直接轉成 PDF,如此一來, PDF 中的文字可被搜尋。
- 避免使用 Adobe Plug-Ins,因為審查員可能沒有權限導致文件內容無法正確顯示。
- 建議使用以下字型:Times New Roman、Verdana、Arial、Tahoma、或 Helvetica。避免使用客製化字型,或在一份文件中使用多種字型。建議全部的送審文件都用同一字型。
- 建議使用黑色字。如要使用黑色以外的字,須避免使用亮色的字,以免灰階列印出來的文字不清楚。(藍色字可用於標示超連結)
- 沒有設定保全選項
- 不可設定密碼。
- 建議不要設定「可看但不可修改」,若開此功能,會影響 FDA 編寫 Confidential Commercial Information 的效率。(但若廠商堅持設定此選項,FDA 還是會收啦。)
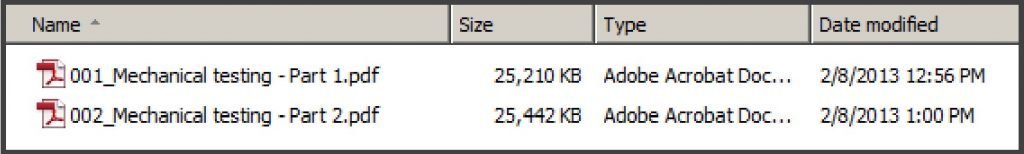
- 單一 PDF ≤ 50 MB
- 用以下方式檢查檔案是否已超過 50 MB (下圖即為過大的 PDF)。

- 不要用「內容」或「滑鼠移到檔案上」來檢查檔案大小,此二方法會低估檔案大小。
- 若檔案過大,須將一個檔案拆成多個檔案。例如下圖:
Step 4 – eCopy 中加入非 PDF 的規定
若需在 eCopy 中加入非 PDF 的檔案,則需
- 建立「MISC FILES」或「 STATISTICAL DATA」資料夾 (此二資料夾可同時存在,或只有其中一個)。


- 此二資料夾名稱需一字不差,但大小寫不拘。
- 將所有 non-PDFs 壓縮成一個或多個 Zip 檔,並放進「MISC FILES」或「 STATISTICAL DATA」資料夾中。
- 單一個 Zip 檔沒有大小限制。
- Zip 檔沒有命名原則的規定。
- 不可將 PDF 檔放入上述兩個資料夾中。
- 建議將以下的檔案,存一份 PDF 檔在一般資料夾外,也存一份原始檔在「MISC FILES」中,以利審查員審查:
- 標示 (Labeling),建議將每個標籤、說明書都分開成個別檔案。
- 510(k)s 的實質比對。
- 510(k) Summary。
- Summary of Safety and Effectiveness Data (SSED) for PMAs。
- Summary of Safety and Probable Benefit (SSPB) for HDEs。
Step 5 – 準備寄送
將 eCopy 放進 CD、DVD、USB 隨身碟中,並附上已簽名的紙本 Company Cover Letter。
Step 6 – 寄送文件
將 Step 5 準備好的包裹,寄給 FDA。
FDA 收件地址請上 FDA 官網確認。例如,現在呈交 510(k) 送審申請需遵循 eCopy 規範,在 FDA 官網「eCopy Program for Medical Device Submissions」內就有以下說明送件地址:
A medical device submission package should be sent to the CDRH Document Control Center (DCC) at the following address:
U.S. Food and Drug Administration
Center for Devices and Radiological Health
Document Control Center (DCC) – WO66-G609
10903 New Hampshire Avenue
Silver Spring, MD 20993-0002
FDA website, “eCopy Program for Medical Device Submissions”

3 留言
請問為什麼建議需要存summary及SE discussion的word檔在MISC資料夾呢?現在改成只需要送eCopy,還需要table of content嗎?
嗨 陳再飛 您好,
關於「為什麼建議需要存 summary 及 SE discussion 的 word 檔在 MISC 資料夾」,主要是因為〈eCopy Program for Medical Device Submissions〉的「2. “MISC FILES” folder」(P.28) 第二段建議如下:
雖然指引這樣寫,但我們實際上沒有這樣做耶。
至於為何指引建議這樣做呢?推測這樣做可以節省審查時間的原因是,有些小問題審查員可以直接改,就不用請廠商改了(?) 像是我們曾經有次被審查員要求修改 510(k) Summary 裡的錯字,猜想如果我們當初有附 Word 檔,審查員就直接幫我們改掉了(吧?)
另外,台灣醫材查驗登記領證時,也要求要附上中文說明書 Word 檔,不知道目的是什麼。
而關於「…需要 table of content 嗎?」,因為「510(k) Format Tips」建議 (非強制規定) 放目錄,因此我們還是有放耶。以下是 FDA 官網原文:
非常謝謝版主的回答,首次要送FDA,這些筆記內容真的是獲益良多。
是的,有看到建議放上table of contents,不過之前是需要寄送紙本,現在只需寄送eCopy(分別放在不同files裡,並非印成同一本),才有這樣的疑問出現。